2020.12.05
検査受託中止のお知らせ(HBs抗原定性)
- 表示拡大はこちら → “お知らせ”
- 謹啓 時下ますますご清祥のこととお慶び申し上げます。日頃は格別のお引き立てを
賜り厚くお礼申し上げます。 - この度、下記の検査項目につきまして、試薬販売元(株式会社シノテスト)より試薬
販売中止の連絡がございました。これに伴い、弊社でもやむなく、検査の受託を中止
することとなりましたので謹んでご案内申し上げます。 - ご利用の先生方には大変ご迷惑をおかけすることと存じますが、何卒ご了承賜ります
よう、よろしくお願い申し上げます - 謹白
- 記
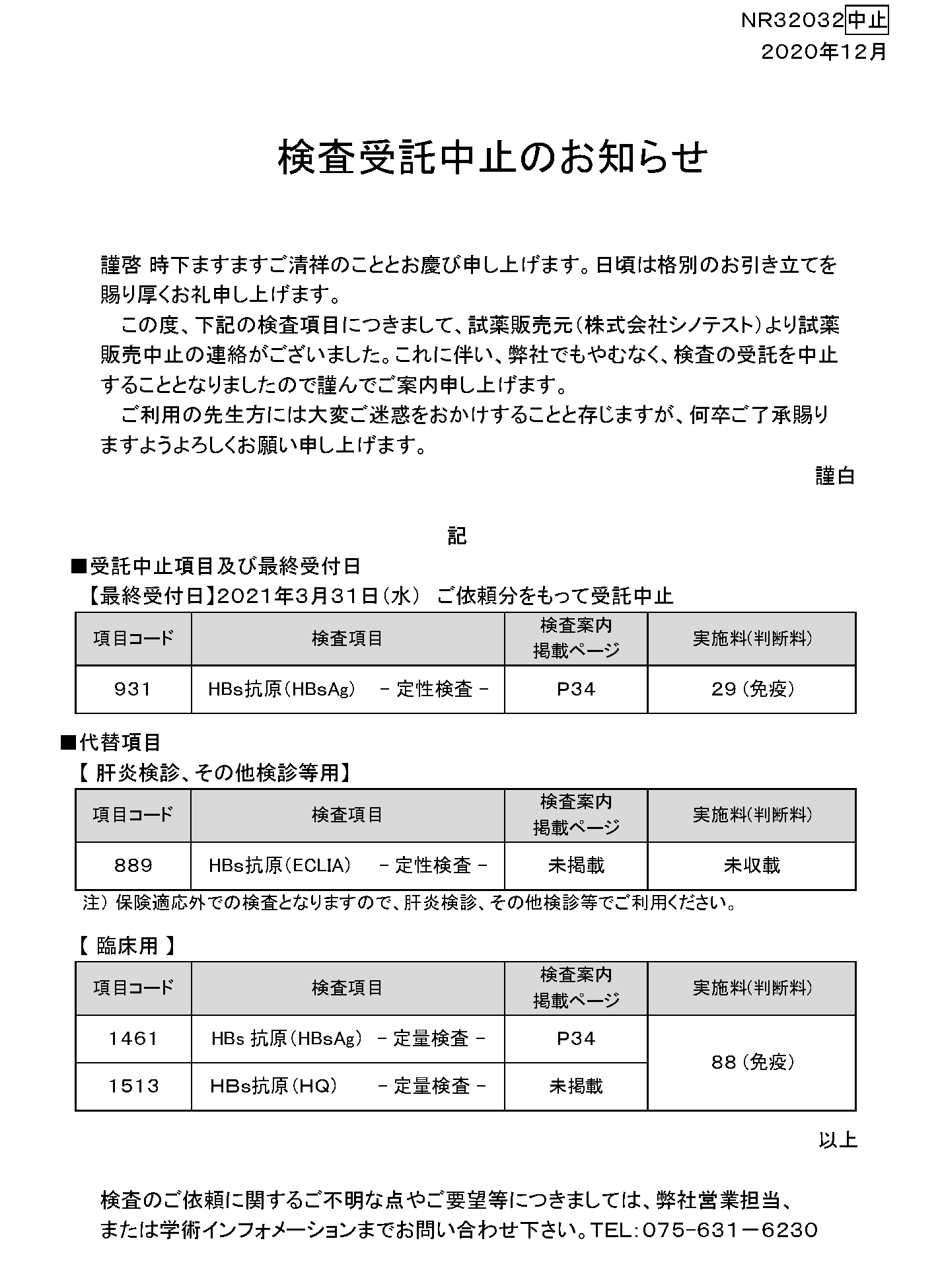
- 【最終受付日】2021年3月31日(水) ご依頼分をもって受託中止
- 【 肝炎検診、その他検診等用】
- 【 臨床用 】
- 近年、HBV感染患者において、強力な免疫抑制剤や化学療法の普及により治療効果が大幅に向上しましたが、一方で、HBV再活性化が問題となっています。
HBV再活性化による肝炎は重症化しやすく、リウマチ性疾患や悪性腫瘍などの原疾患の治療が困難となるため、予防が重要となってきます。 - HBV再活性化の対策ガイドラインでは、治療前の全例に、HBs抗原をスクリーニング検査することとされており、2020年の診療報酬改定において保険適用条件※1が追加されました。
- また、日本肝臓学会編『B型肝炎治療ガイドライン(第3.2版)』(2020年7月公開)では、スクリーニングに感度の高い方法の使用が推奨されています。
各ガイドラインで推奨されている高感度法のHBs抗原(HQ)を改めてご案内いたします。 - ※1 診療報酬算定条件
- 免疫抑制剤の投与や化学療法を行う患者に対して、B型肝炎の再活性化を考慮し、当該治療開始前に
「D013」肝炎ウイルス関連検査の「3」のHBs抗原、HBs抗体及び「6」のHBc抗体半定量・定量を同時
に測定した場合は、患者1人につきそれぞれ1回に限り算定できる。 - 以上
- 検査のご依頼に関するご不明な点やご要望等につきましては、弊社営業担当、または
- 学術インフォメーションまでお問い合わせ下さい。 TEL:075-631-6230
■PDFのダウンロードはこちら → ![]()
NR32032変更
2020年12月
検査受託中止のお知らせ
■受託中止項目及び最終受付日
| 項目コード |
検査項目 |
検査案内 掲載ページ |
実施料 (判断料) |
| 931 |
HBs抗原(HBsAg) – 定性検査 – |
P34 |
29(免疫) |
■代替項目
| 項目コード |
検査項目 |
検査案内 掲載ページ |
実施料(判断料) |
| 889 |
HBs抗原(ECLIA) – 定性検査 – |
未掲載 |
未収載 |
注) 保険適応外での検査となりますので、肝炎検診、その他検診等でご利用ください。
| 項目コード |
検査項目 |
検査案内 掲載ページ |
実施料(判断料) |
| 1461 |
HBs抗原(HBsAg) – 定量検査 – |
P34 |
88(免疫) |
| 1513 |
HBs抗原(HQ) – 定量検査 – |
未掲載 |
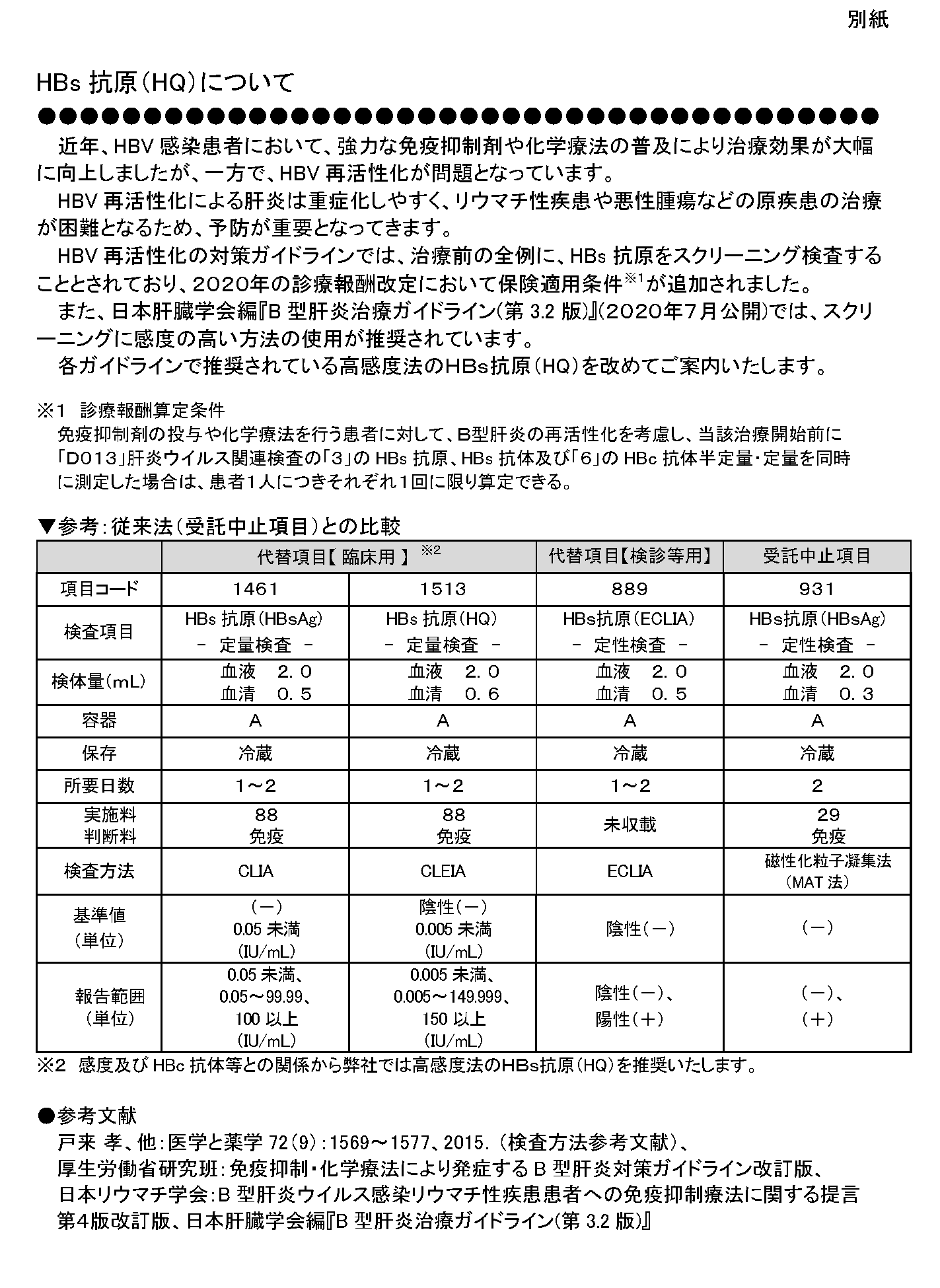
HBs抗原(HQ)について
▼参考:従来法(受託中止項目)との比較
|
|
代替項目 【 臨床用 】 ※2 |
代替項目 【検診等用】 |
受託中止項目 |
|
| 項目コード |
1461 |
1513 |
889 |
931 |
| 検査項目 |
HBs抗原(HBsAg) - 定量検査 - |
HBs抗原(HQ) - 定量検査 - |
HBs抗原(ECLIA) - 定性検査 - |
HBs抗原(HBsAg) - 定性検査 - |
| 検体量(mL) |
血液 2.0 血清 0.5 |
血液 2.0 血清 0.6 |
血液 2.0 血清 0.5 |
血液 2.0 血清 0.3 |
| 容器 |
A |
A |
A |
A |
| 保存 |
冷蔵 |
冷蔵 |
冷蔵 |
冷蔵 |
| 所要日数 |
1~2 |
2 |
1~2 |
2 |
| 実施料 判断料 |
88 免疫 |
88 免疫 |
未収載 |
29 免疫 |
| 検査方法 |
CLIA |
CLEIA |
ECLIA |
磁性化粒子凝集法 (MAT法) |
| 基準値 (単位) |
(-) 0.05未満 (IU/mL) |
陰性(-) 0.005未満 (IU/mL) |
陰性(-) |
(-) |
| 報告範囲 (単位) |
0.05未満、 0.05~99.99、 100以上 (IU/mL) |
0.005未満、 0.005~149.999、 150以上、 (IU/mL) |
陰性(-)、 陽性(+) |
(-)、 (+) |
※2 感度及びHBc抗体等との関係から弊社では高感度法のHBs抗原(HQ)を推奨いたします。
●参考文献
戸来 孝、他:医学と薬学72(9):1569~1577、2015.(検査方法参考文献)、
厚生労働省研究班:免疫抑制・化学療法により発症するB型肝炎対策ガイドライン改訂版、
日本リウマチ学会:B型肝炎ウイルス感染リウマチ性疾患患者への免疫抑制療法に関する提言
第4版改訂版、日本肝臓学会編『B型肝炎治療ガイドライン(第3.2版)』
 ~LINE公式アカウントを開設しました~
~LINE公式アカウントを開設しました~新型コロナウイルス情報、弊社からのお知らせ、最新トピックス、採用等の情報をスマホで確認いただけます。
またAI機能を用いた検査項目検索など様々な機能があります。弊社検査案内の代わりにご利用いただけます。
-
PDFはこちら → “日本臨床LINE”
追加登録はこちら ↓












