2021.02.17
新型コロナウイルス関連検査受託体制の強化について
新型コロナウイルス関連検査受託体制の強化について
- 表示拡大はこちら → “お知らせ”

- 謹啓 時下ますますご清祥のこととお慶び申し上げます。日頃は格別のお引き立てを賜り
厚くお礼申し上げます。 - 弊社では、昨年3月6日より帰国者・接触者外来を設置している医療機関等からPCR検査
の受託を開始して以降、ウイルスの感染拡大とともに急速に増加する新型コロナウイルス関連
検査の需要に応えるべく、段階的に検査設備の拡充と検査体制の見直しを図ってまいりました。 - この度、さらなる受託体制の強化の為、下記の検査項目において、新規受託と検査内容の
変更をさせていただくこととなりましたので謹んでご案内申し上げます。 - 謹白
- 記
- [実施日]2021年2月20日(土)ご依頼分より
- 【新規受託開始】
- 【検査内容変更】 体外診断医薬品(IVD)承認取得試薬への変更となります。
- ▼新法と現法の比較 相関一致表 ※弊社グループ会社内検討結果
- -スパイク(S)タンパク質に対する抗体(IgGを含む)を測定する定量検査です-
- 新型コロナウイルス(SARS-CoV-2)は、スパイク(S)、エンベロープ(E)、メンブレン(M)、ヌクレオカプシド(N)の4種類の構造タンパク質で構成されています。コロナウイルスに特徴的な表面の突起を形成するSタンパク質には、ヒト細胞に感染する際に不可欠な受容体結合ドメイン(RBD)が存在しています。RBDが、ヒトの呼吸器や粘膜の上皮細胞表面に存在するアンジオテンシン変換酵素2型(ACE2)受容体と結合することで、ウイルスは宿主細胞に侵入します。
- SARS-CoV-2ワクチンは、Sタンパク質特異的に免疫反応を誘発するよう設計されているものが多く、Sタンパク質に対する抗体検査は、ワクチン接種前の免疫状態の確認およびワクチン接種後の免疫応答の定量測定などの使用が期待されています。
- 本検査は、ロシュ・ダイアグノスティックス社の研究用試薬「Elecsys® Anti-SARS-CoV-2 S」を用い、検体中のSARS-CoV-2 Sタンパク質のRBDに対する抗体(IgGを含む)を定量的に測定する検査であり、定量値と判定結果をご報告いたします。
- - 留意事項 -
- ロシュ・ダイアグノスティックス社の研究用試薬「Elecsys® Anti-SARS-CoV-2 S」を用いた研究検査項目です
- -SARS-CoV-2に対するIgM抗体を検出する定性検査です-
- 新型コロナウイルス(SARS-CoV-2)による感染症(COVID-19)は、2019年12月に中国武漢市において確認されて以降、世界的な感染拡大が続いています。
- 本邦では、COVID-19に関連する臨床検査として、診断を目的とした核酸増幅法および抗原検出が保険適用となっていますが、抗体検査については、臨床現場での利用の仕方や結果解釈についての見解は定まっていません。一方で、日本から中国へ渡航する際には、PCR検査に加え血清IgM検査の陰性証明の提示が必要となっています。
- 本検査は、アボットジャパン社の研究用試薬「ARCHITECT SARS-CoV-2 IgM」を用い、検体中のSARS-CoV-2のスパイク蛋白質に対するIgM抗体を検出する定性検査です。本試薬は、欧州での使用を可能とするCEマークを取得し、米食品医薬品局(FDA)の緊急使用許可(EUA)を得ています。
- - 留意事項 -
- 1) アボットジャパン社の研究用試薬「ARCHITECT SARS-CoV-2 IgM」を用いた研究検査項目です。
- 2) 本検査の判定が陰性であっても、SARS-CoV-2感染を否定するものではありません。
- 3) 本検査の結果を唯一の根拠として、SARS-CoV-2感染の診断、感染の可能性の除外、
- 感染の有無の告知を行うことはできません。
- 4) 免疫不全の患者では、新型コロナウイルス感染症(COVID-19)であっても抗体の産生が遅く、
- 抗体量が少ないために測定結果が陽性とならない場合があります。
- 以上
- 検査のご依頼に関するご不明な点やご要望等につきましては、弊社営業担当、または
- 学術インフォメーションまでお問い合わせ下さい。 TEL:075-631-6230
■PDFのダウンロードはこちら → ![]()
NR32037案内
2021年2月
新型コロナウイルス関連検査受託体制の強化について
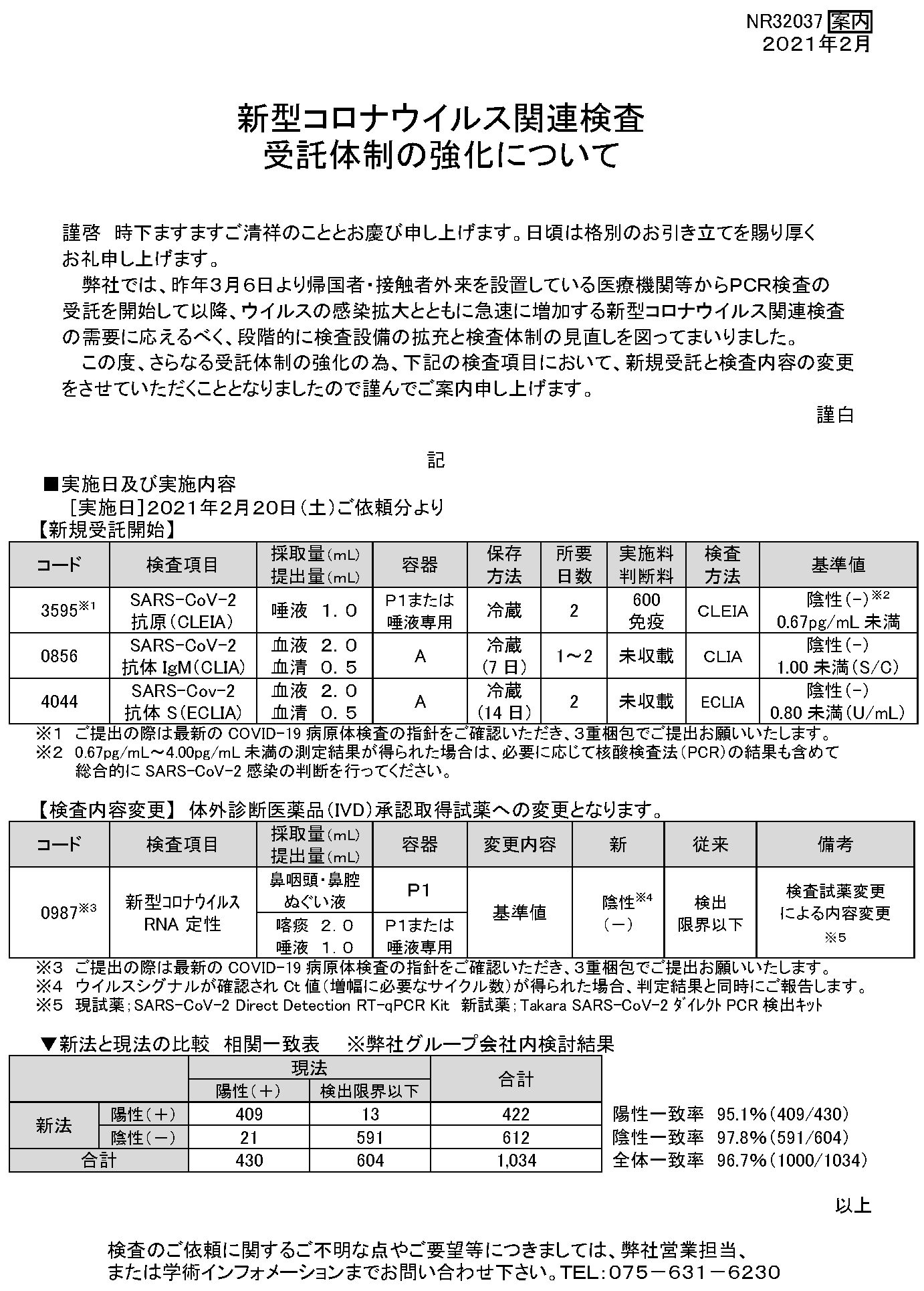
■実施日及び実施内容
| コード |
検査項目 |
採取量(mL) 提出量(mL) |
容器 |
保存 方法 |
所要 日数 |
実施料 判断料 |
検査 方法 |
基準値 |
| ※13595※1 |
SARS-CoV-2 抗原(CLEIA) |
唾液 1.0 |
P1または 唾液専用 |
冷蔵 |
2 |
600 免疫 |
CLEIA |
※2陰性(-)※2 0.67pg/mL未満 |
| 0856 |
SARS-CoV-2 抗体IgM(CLIA) |
血液 2.0 血清 0.5 |
A |
冷蔵 (7日) |
1~2 |
未収載 |
CLIA |
陰性(-) 1.00未満(S/C) |
| 4044 |
SARS-Cov-2 抗体 S(ECLIA) |
血液 2.0 血清 0.5 |
A |
冷蔵 (14日) |
2 |
未収載 |
ECLIA |
陰性(-) 0.80未満(U/mL) |
※1 ご提出の際は最新のCOVID-19病原体検査の指針をご確認いただき、3重梱包でご提出をお願いいたします。
※2 0.67pg/mL~4.00pg/mL未満の測定結果が得られた場合は、必要に応じて核酸検査法(PCR)の結果も含めて
総合的にSARS-CoV-2感染の判断を行ってください。
| コード |
検査項目 |
採取量(mL) 提出量(mL) |
容器 |
変更内容 |
新 |
従来 |
備考 |
| ※30987※3 |
新型コロナウイルス RNA定性 |
鼻咽頭・鼻腔 ぬぐい液 |
P1 |
基準値 |
※4陰性※4 (-) |
検出 限界以下 |
検査試薬変更 による内容変更 ※5 |
| 喀痰 2.0 唾液 1.0 |
P1または 唾液専用 |
※3 ご提出の際は最新のCOVID-19病原体検査の指針をご確認いただき、3重梱包でご提出をお願いいたします。
※4 ウイルスシグナルが確認されCt値(増幅に必要なサイクル数)が得られた場合、判定結果と同時にご報告します。
※5 現試薬;SARS-CoV-2 Direct Detection RT-qPCR Kit 新試薬;Takara SARS-CoV-2 ダイレクトPCR検出キット
|
|
現法 |
合計 |
|
||
| 陽性(+) |
検出限界以下 |
|
|||
| 新法 |
陽性(+) |
409 |
13 |
422 |
陽性一致率 95.1%(409/430) |
| 陰性(-) |
21 |
591 |
612 |
陰性一致率 97.8%(591/604) |
|
|
合計 |
430 |
604 |
1,034 |
全体一致率 96.7%(1000/1034) |
|
● SARS-CoV-2抗体 S 〔ECLIA〕 【4044】
[4044] SARS-Cov-2抗体 S(ECLIA)の判定基準
| (U/mL) |
判定 |
| <0.80 |
陰性 |
| ≧0.80 |
陽性 |
● SARS-CoV-2抗体 IgM 〔CLIA〕 【0856】
[0856] SARS-CoV-2抗体IgM〔CLIA〕の判定基準
| (S/C) |
判定 |
| <1.00 |
陰性 |
| ≧1.00 |
陽性 |
 ~LINE公式アカウントを開設しました~
~LINE公式アカウントを開設しました~新型コロナウイルス情報、弊社からのお知らせ、最新トピックス、採用等の情報をスマホで確認いただけます。
またAI機能を用いた検査項目検索など様々な機能があります。弊社検査案内の代わりにご利用いただけます。
-
PDFはこちら → “日本臨床LINE”
追加登録はこちら ↓












